
蛋白质乳酸化的发现
长期以来,乳酸(lactate)被视为细胞代谢中的“废弃物”。在经典代谢路径中,细胞在缺氧或高强度代谢状态下会启动糖酵解,快速将葡萄糖转化为丙酮酸。由于缺乏氧气,丙酮酸无法进入线粒体的三羧酸循环,而是被还原为乳酸,以再生NAD⁺供糖酵解持续进行。这一过程虽然维持了能量供应,却也导致乳酸大量积累,因此乳酸长期被贴上“无氧代谢副产物”的标签,被认为需要通过转运或肝脏代谢清除以维持内环境稳定。
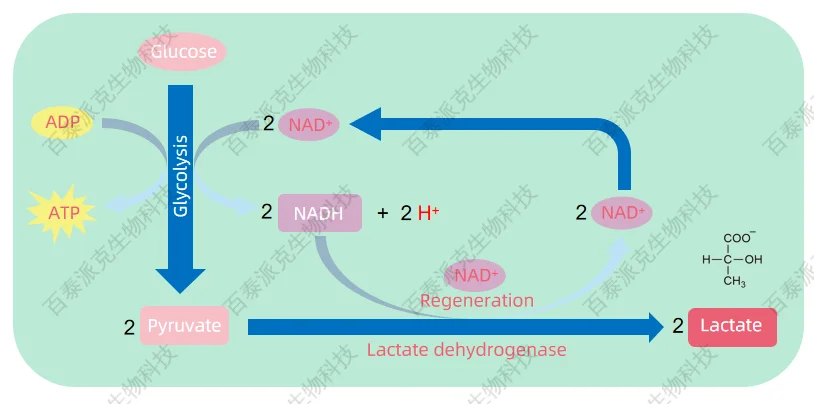
图1. 有氧糖酵解
然而,近年来的研究表明,乳酸并非“无用之物”,而是具备多种调控功能的活性代谢分子。它不仅能作为代谢燃料在不同细胞之间“转运利用”,还可通过特定的乳酸受体(如GPR81)参与细胞信号转导,调节免疫、神经与内分泌活动。更重要的是,乳酸作为代谢中间物,能够通过酰基化修饰赖氨酸残基,形成一种新型的蛋白翻译后修饰——乳酸化(lactylation),揭示了代谢状态与基因表达之间直接耦联的新机制。
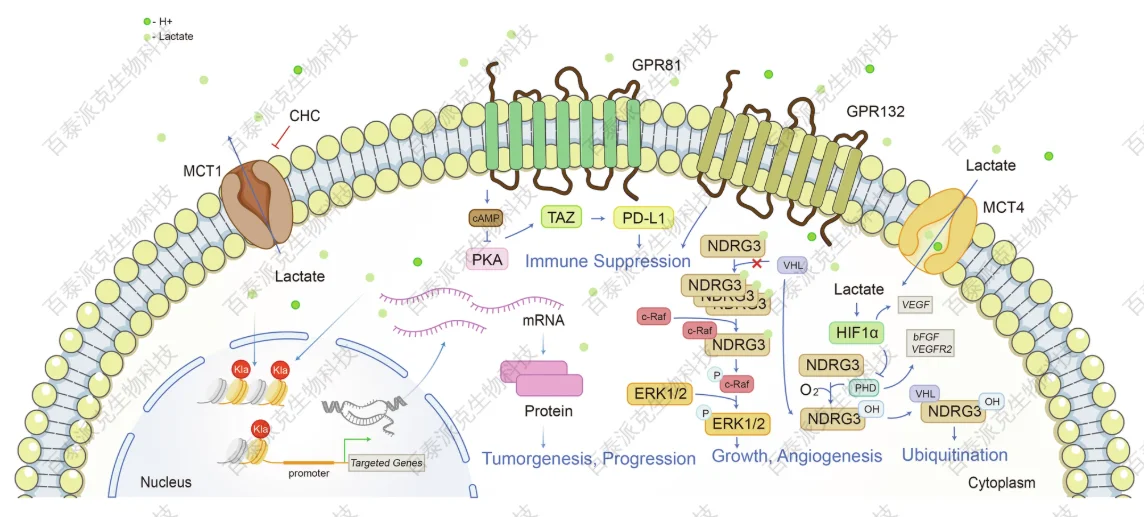
Chen, J. et al. Signal Transduct Target Ther. 2025.
图2. 乳酸是细胞内和细胞外重要的信号转导子
在高代谢活动的细胞或组织中,如肿瘤细胞、活化的免疫细胞(如巨噬细胞)和缺血区域的组织细胞,乳酸常常呈现高浓度积累状态。这些环境下产生的乳酸不再只是能量代谢的副产品,而是作为结构碳源参与调控基因表达。蛋白质乳酸化的发现为人们理解“代谢-表观遗传-功能”之间的转化关系提供了新的视角,也为相关疾病的机制研究与干预策略开发打开了全新思路。
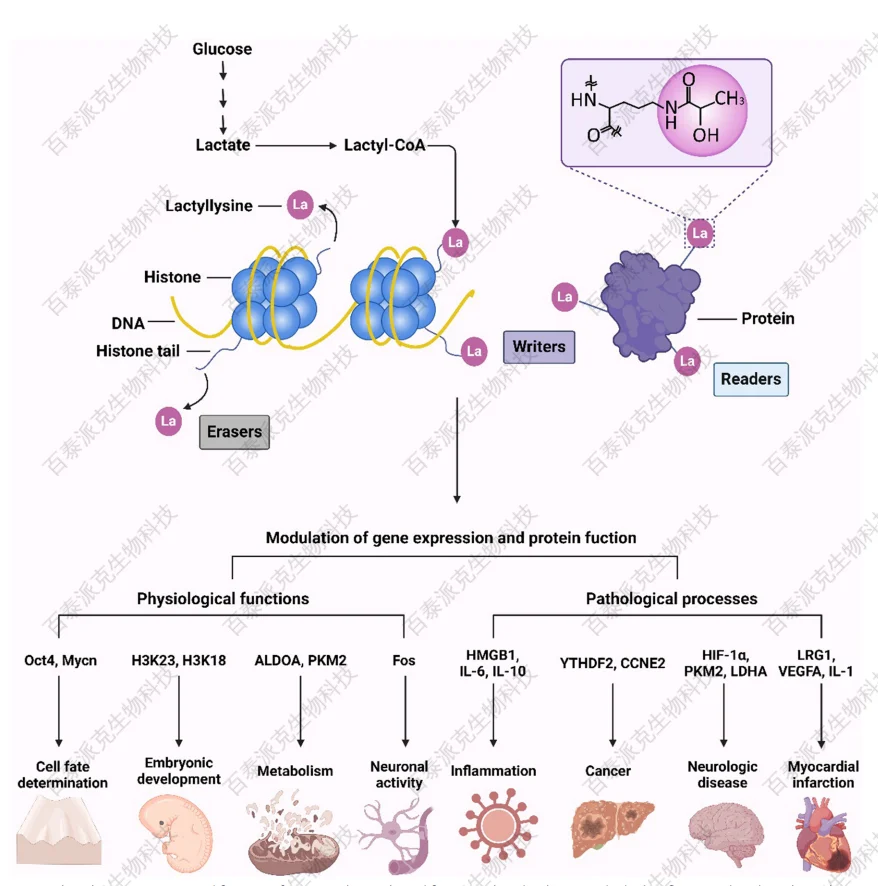
Hu Y, et al. Clin Epigenetics. 2024.
图3. 蛋白质乳酸化调控基因表达和蛋白质功能
乳酸化机制
蛋白质乳酸化(lactylation)是一种新型赖氨酸翻译后修饰,化学上表现为乳酸基团(–CO–CH₃OH)通过酰胺键共价修饰蛋白质上的赖氨酸残基。这一过程被认为主要依赖于代谢中间体——乳酰辅酶A(lactoyl-CoA)作为酰基供体,在一定酶促或非酶促条件下完成共价结合。lactoyl-CoA 的生成可能来源于糖酵解增强、乳酸积累或辅酶A参与下的代谢旁路活跃状态。
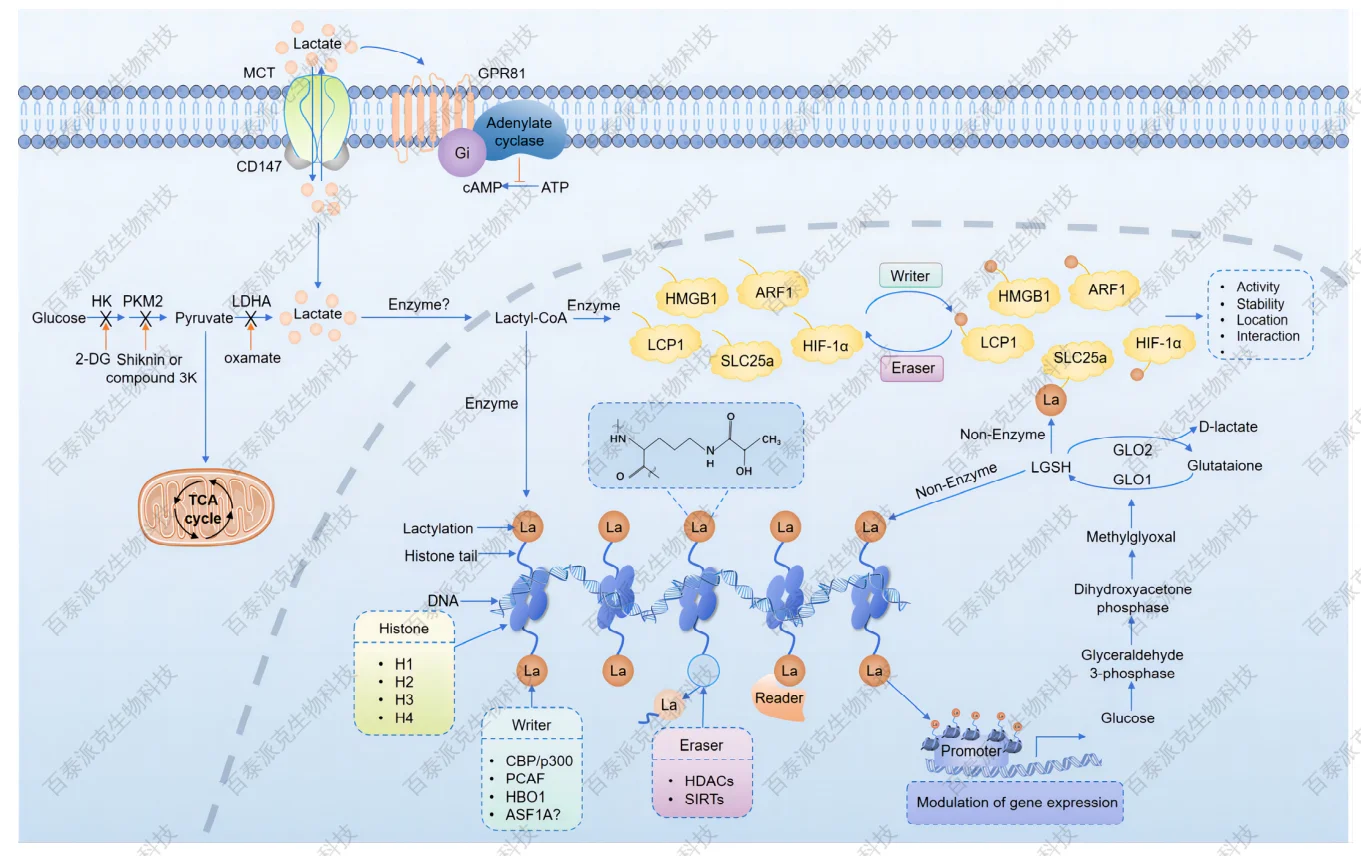
Liu J, et al. Biomolecules. 2024.
图4. 乳酸化的机制和调控
尽管乳酸化相关的“writer”酶(即介导乳酸化修饰的催化酶)尚未被系统确证,但已有研究提出p300/CBP等组蛋白乙酰转移酶(HATs)可能具有双功能,能在特定代谢背景下将乳酸基团转移到组蛋白和非组蛋白赖氨酸上。有研究表明,p300在高乳酸条件下与乳酰辅酶A存在直接结合能力,可调节特定位点的乳酸化水平。此外,近期也有研究尝试通过高通量筛选方式识别潜在的乳酸化转移酶,但目前尚无特异性强、功能明晰的“writer”得到公认。
相较于writer系统,乳酸化的“eraser”酶(去乳酸化酶)研究则更加初步。某些去乙酰化酶家族成员,如HDACs或Sirtuins(特别是SIRT2、SIRT3),在体外实验中被观察到具有一定的去乳酸化活性,但其底物特异性、细胞内靶标及调控条件仍需进一步验证。由于乳酸化与乙酰化在质量数与结构上接近,传统酶筛选方法对两者的识别区分存在技术挑战,制约了eraser研究的深入。
此外,对于乳酸化是否存在“reader”蛋白——即识别乳酸化修饰并介导下游功能效应的结构域,目前尚无明确定义的乳酸化识别结构域(如乙酰化的bromodomain或甲基化的chromodomain)。然而,有研究推测某些转录因子或染色质重塑复合物可能通过感应乳酸化位点变化参与染色质状态调控,这一方向仍处于早期探索阶段。
值得注意的是,乳酸化与其他赖氨酸修饰(如乙酰化、甲基化、泛素化等)在同一位点可能存在竞争性关系,也可能形成串扰网络。在应激、缺氧、炎症等微环境下,这些修饰动态变化共同塑造蛋白质功能状态和基因表达图谱。因此,乳酸化不仅是一个独立修饰事件,更嵌套在更复杂的“多修饰交互调控网络”中,其调控模式具有显著的条件依赖性和细胞特异性。
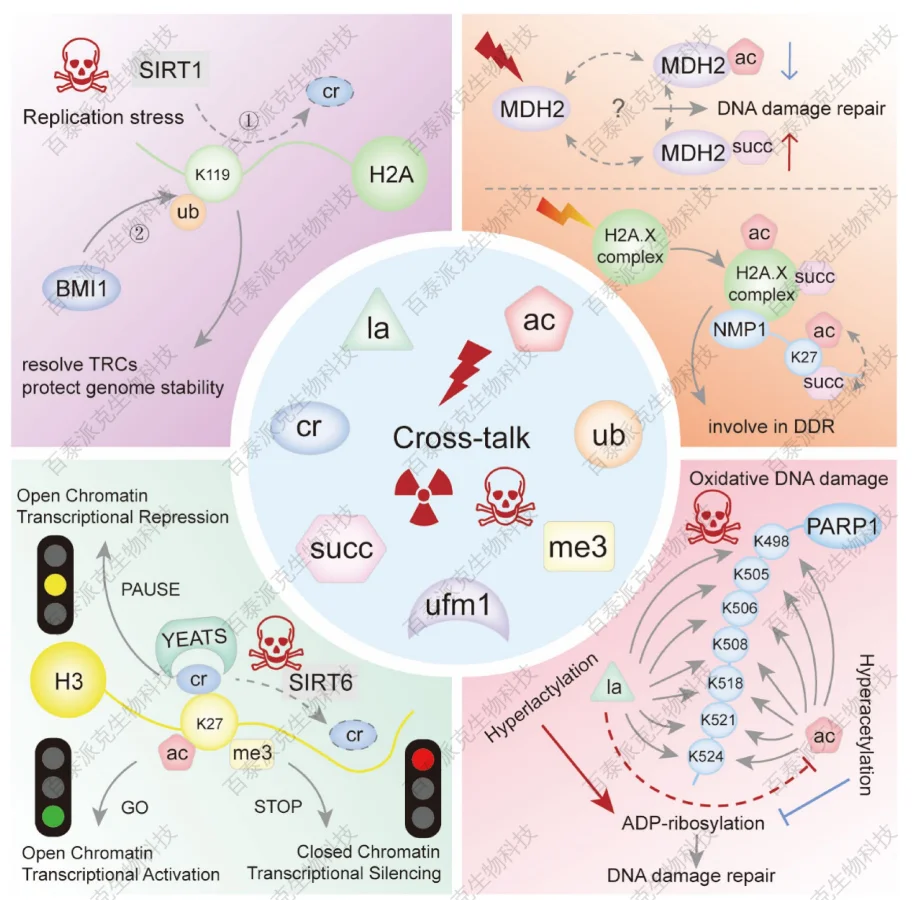
Song, H. et al. Genes Dis. 2022.
图5. DNA损伤反应中乳酸化相互作用示意图
组蛋白乳酸化与非组蛋白乳酸化
乳酸化最初是在组蛋白上被发现的,尤其是在组蛋白H3的赖氨酸残基(如H3K18、H3K9)上。组蛋白乳酸化会改变染色质的结构状态,从而调节基因转录活性。实验表明,在缺氧或炎症刺激下,组蛋白乳酸化水平升高,参与调节促炎因子、修复相关基因等的表达。随着检测技术的进步,越来越多的非组蛋白蛋白质也被发现可发生乳酸化修饰。这些蛋白包括转录因子、代谢酶、信号通路蛋白等,提示乳酸化不仅仅限于染色质调控,还可能直接影响细胞代谢、免疫识别、细胞迁移等多种生物过程,其功能范围远比最初设想的更加广泛。
非组蛋白乳酸化修饰过程涉及一系列精细的酶促反应,首先是由乳酸化酶(如赖氨酸乳酸化转移酶)将乳酸基团添加到目标蛋白质的赖氨酸残基上。这一过程通常在细胞内的能量代谢压力下发生,特别是在缺氧、炎症反应或代谢应激条件下,乳酸浓度上升,激活乳酸化转移酶。在乳酸化过程中,乳酸基团通过酰胺键与赖氨酸的氨基结合,形成可逆的乳酸化修饰。此修饰不仅改变蛋白质的构象和稳定性,还通过影响蛋白-蛋白相互作用、亚细胞定位及其催化活性,调控多种细胞过程,如基因转录、细胞周期、免疫反应和细胞迁移等,成为重要的生物学调控机制。
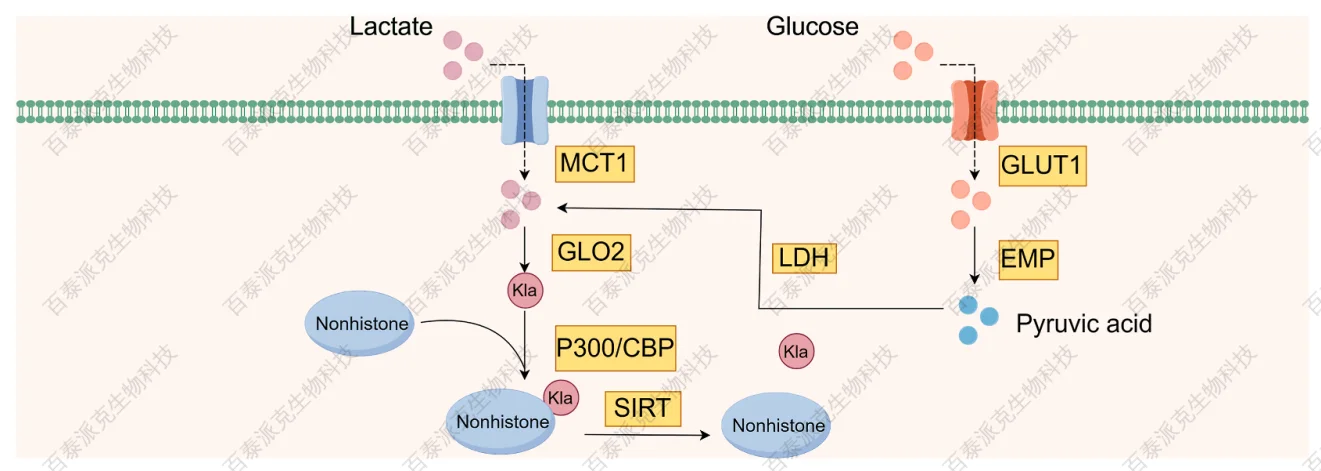
Yu, H. et al. Heliyon. 2024.
图6. 非组蛋白乳酸化的产生
乳酸化与疾病:从机制到病理相关性
乳酸化正被逐步证实在多种重大疾病中发挥重要调控作用。其核心机制在于:乳酸积累通过修饰蛋白质赖氨酸残基,改变基因表达和细胞功能,进而介入炎症、免疫、代谢及神经系统等多层面调控。
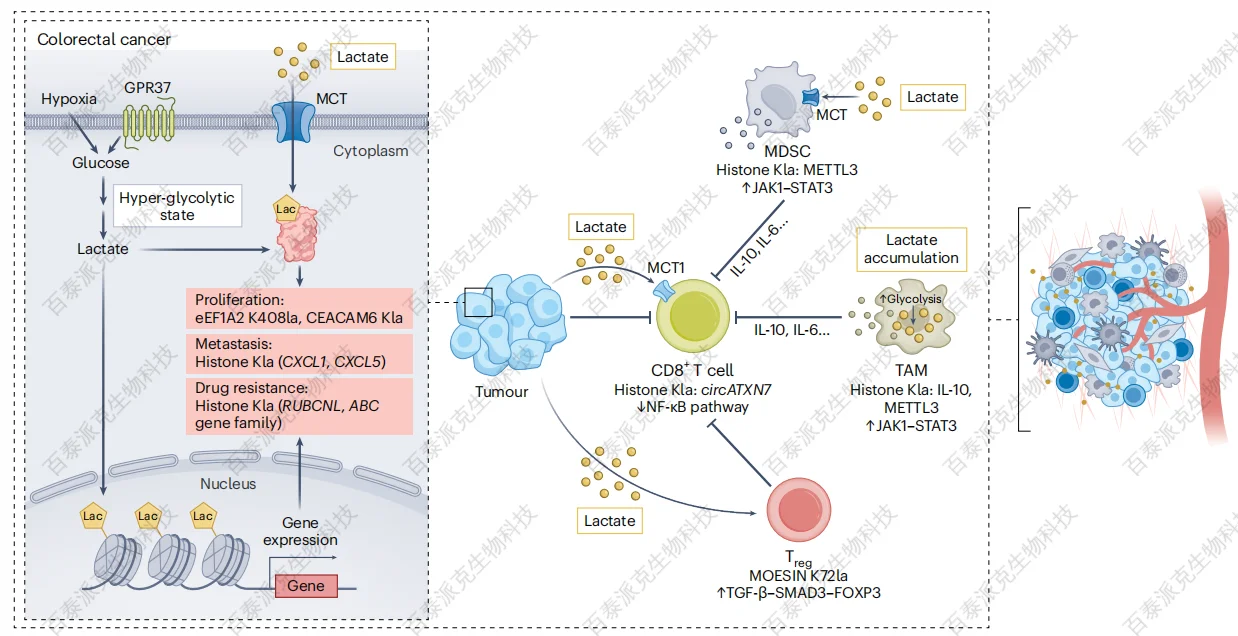
Ren, H. et al. Nat Metab. 2025.
图7. 肿瘤中的蛋白质乳酸化
乳酸化通过代谢感应与表观调控的耦联,在多类疾病中呈现出重要的调节作用,未来有望成为疾病干预的新靶点。
乳酸化相关的治疗靶点与干预策略
由于乳酸化在疾病中的重要作用,越来越多研究开始探索其作为治疗靶点的可行性。一个重要思路是通过调节细胞内的乳酸浓度来间接影响乳酸化水平。例如,抑制乳酸生成的乳酸脱氢酶(LDH)抑制剂或阻断乳酸外排的单羧酸转运蛋白(MCT)抑制剂已被用于实验性治疗中。
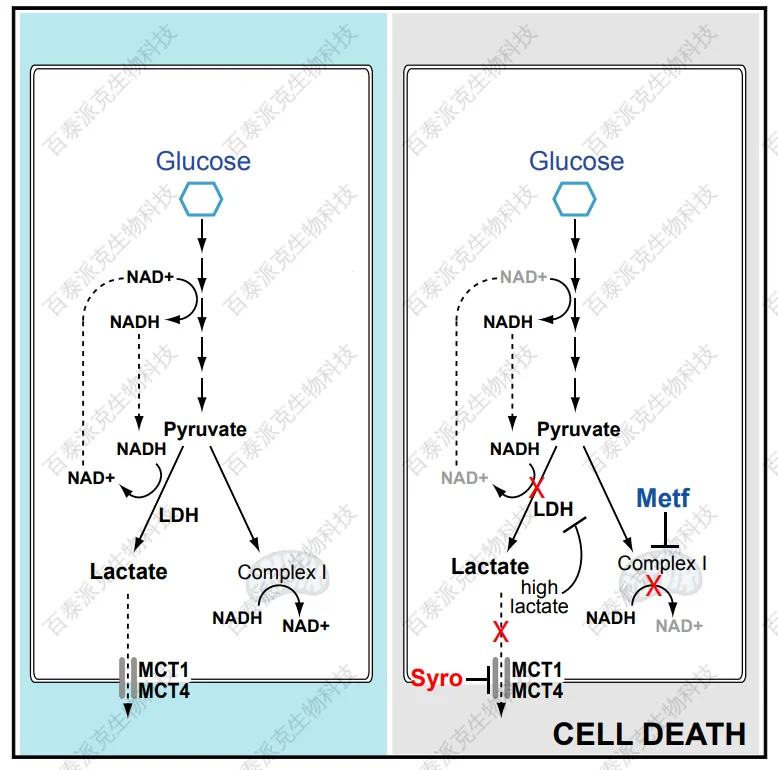
Benjamin, D. et al. Cell Rep. 2018.
图8. MCT抑制剂昔洛舍平抑制乳酸生成的机制
同时,研究人员也在尝试寻找乳酸化的“writer”、“eraser”和“reader”蛋白质,以开发靶向酶调控的干预策略。尽管目前尚无乳酸化特异性的小分子药物进入临床,但它已成为表观调控与代谢干预结合的新兴领域,未来具有巨大的转化潜力。
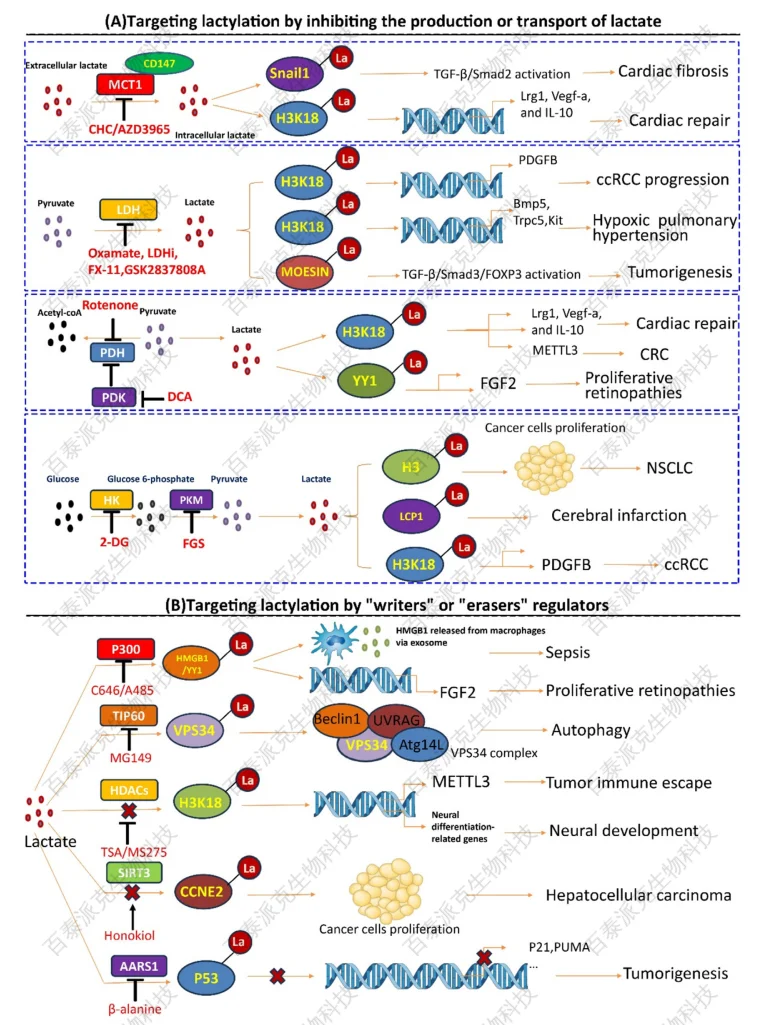
Hu, XT. et al. J Adv Res. 2024.
图9. 靶向乳酸化调控策略
乳酸化分析方法
乳酸化的发现离不开先进的质谱技术,目前主流的分析流程包括:蛋白质酶解后富集乳酸化肽段,采用高分辨率LC-MS/MS进行检测,并通过数据库比对与人工校正实现乳酸化位点的鉴定与定量。常用的数据库搜索引擎如pFind、Byonic等,已支持乳酸化修饰的识别。
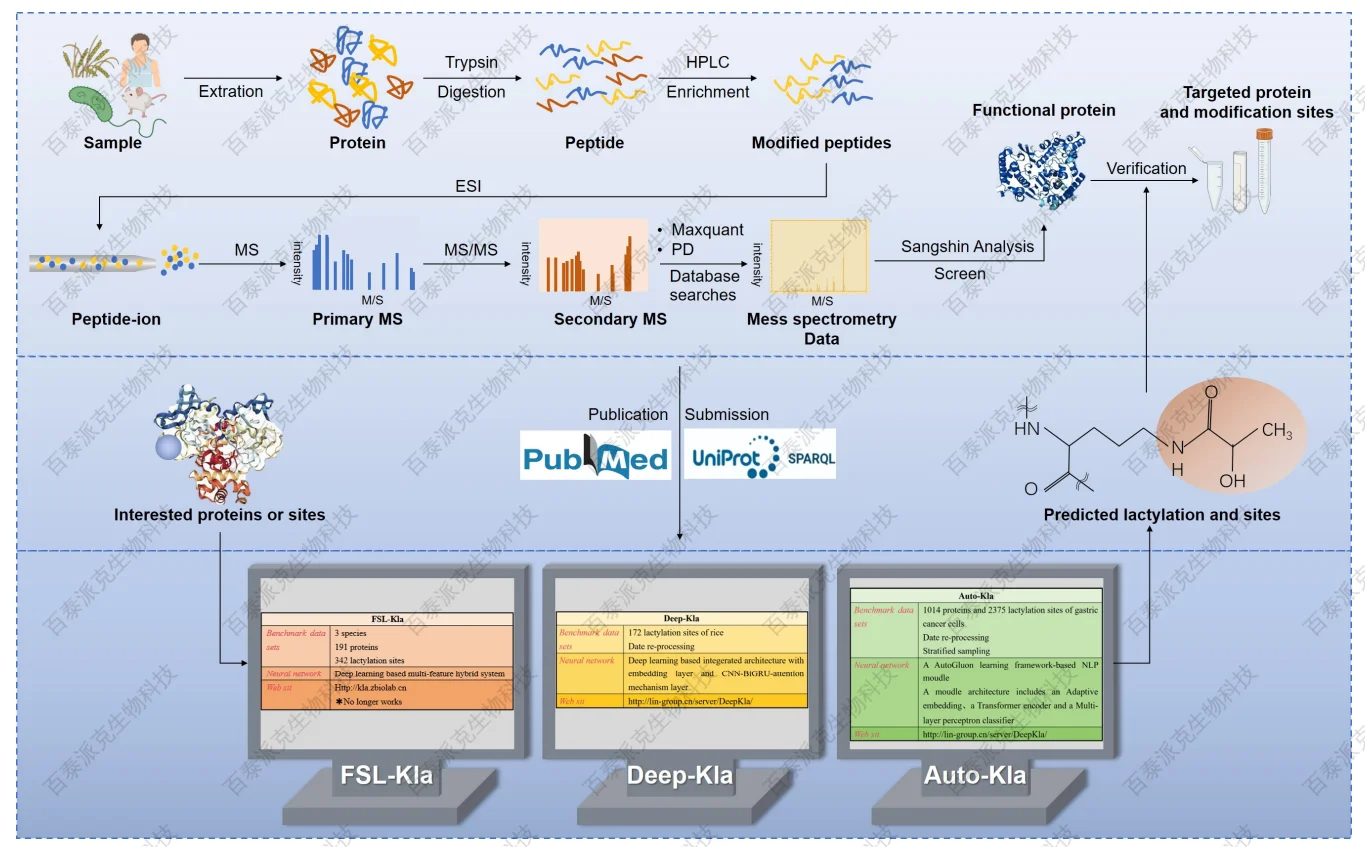
Liu, J. et al. Biomolecules. 2024.
图10. 乳酸化分析流程
此外,为提升检测灵敏度和特异性,研究者还在开发乳酸化特异性抗体,用于Western blot或免疫富集。未来,随着抗体质量提升和多重串扰识别算法的发展,乳酸化组学将从“发现阶段”迈入“功能解析与系统建模”阶段,推动该领域的进一步成熟。
结语
乳酸化作为一种代谢驱动型的蛋白质修饰方式,正逐步改变人们对“乳酸只是废物”的旧有认知。它在连接代谢状态、染色质状态与细胞功能方面发挥着桥梁作用,为我们理解疾病机制、发现治疗靶点、构建调控网络提供了新的视角。
虽然目前关于乳酸化的研究仍处于起步阶段,存在机制不清、技术受限等问题,但其科学意义和应用潜力无可忽视。百泰派克将持续关注并推进乳酸化相关的蛋白质组学技术开发,为基础研究与生物医药转化提供有力支持。
如需了解百泰派克在乳酸化修饰研究方面的分析服务,欢迎联系我们的技术团队获取详细信息与个性化方案建议。
关于我们
北京百泰派克生物科技有限公司致力于为生物/制药和医疗器械行业提供质量控制检测和项目验证等专业服务。公司实验室遵循NMPA、ICH、FDA和EMA等的法规和指导原则,通过CNAS/ISO9001双重质量体系认证,建立了完备的质量体系,数据冷热/异地备份,设备定期计量/期间核查,软件审计追踪,为客户提供一体化解决方案和技术服务,支持新药研发、药物申报注册和生产放行。
1.公司采用ISO9001质量控制体系,专业提供以质谱为基础的CRO检测分析服务;
2.获国家CNAS实验室认可,为客户提供符合全球药政法规的药物质量研究服务;
3.业务范围覆盖蛋白质组学、多肽组学、代谢组学、生物药物表征、单细胞分析、单细胞质谱流式、生信云分析以及多组学生物质谱整合分析等;
4.七大质量控制检测平台,满足您一站式服务需求;
5.服务3000+企业,10000+客户的选择;
6.致力于为您提供优质的生物质谱分析服务!
